À retenir
Une étude menée en vraie vie auprès de 220 patients souffrant de maladie inflammatoire chronique des intestins (MICI) vient de montrer que le CT-P13, biosimilaire de l’infliximab est un traitement efficace et bien toléré. Ces données confortent l’intérêt d’utiliser les biosimilaires.
Pourquoi est-ce important ?
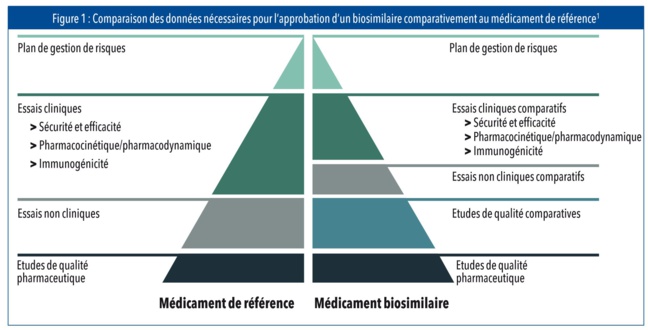
Le développement de biosimilaires est venu résoudre un problème de coût sur des traitements ayant révolutionné la prise en charge des MICI. Leur efficacité et tolérance versus le produit princeps a fait l’objet d’études en amont de leur commercialisation mais il est intéressant d’en évaluer la transposition en vie réelle.
Méthodologie
Cette étude observationnelle, prospective, multicentrique s’est intéressée à l’efficacité et à la tolérance du CT-P13, biosimilaire de l’infliximab, administré chez des sujets naïfs de traitement biologique ou ayant une réponse insuffisante à un autre anti-TNF ou ayant switché de l’infliximab original au biosimilaire. Les critères d’évaluation de l’activité de la maladie étaient l’indice de Harvey-Bradshaw>4 ou la présence d’une fistule périanale pour la la maladie de Crohn (MC) et un score partiel Mayo>2 pour la rectocolite hémorragique (RCH).
Principaux résultats
Au total, parmi les 220 patients souffrant de MICI traités par CT-P13 et inclus dans l’étude, 60% souffraient de MC et 40% de RCH. L’âge moyen était de 41,47 ans et 58% étaient des femmes. Sur l’ensemble de ces sujets, 9% avaient switché d’un traitement par infliximab original au biosimilaire, 65% étaient naïfs de tout traitement biologique avant d’avoir initié le traitement par CT-P13. À l’inclusion, 68,6% des individus présentaient une maladie active.
Une diminution significative des indices d’activité de la MC et de la RCH a été constatée à 3, 6 et 13 mois de traitement par CT-P13. Après 3 mois de traitement, 75,5% de la population avait atteint la rémission clinique ou une réponse clinique. Ils étaient 85,2% à avoir atteint ces mêmes critères à 12 mois de traitement. Si l’on considère la rémission clinique seule, sans recours aux corticoïdes, 64,2% des individus avaient atteint ce critère après 12 mois de traitement et 14,8% présentaient encore une maladie active. Parmi les patients qui avaient switché de l’infliximab princeps au biosimilaire (n=19), dix avaient terminé les 12 mois de suivi et parmi eux, 83,3% ont atteint la rémission.
À 3 mois, des anticorps anti-CT-P13 ont été retrouvés chez 10,5%, 4%, 6,7% et 26,1% des individus respectivement à 3, 6 mois, 9 mois et 12 mois.
Sur l’ensemble de la cohorte, des effets indésirables ont été rapportés pour 12,3% des individus. Les plus fréquents étaient des infections (23,5%) et des réactions au site d’injection (26,5%). Parmi les effets indésirables, 26,5% ont été qualifiés de graves.
Une étude menée en vraie vie auprès de 220 patients souffrant de maladie inflammatoire chronique des intestins (MICI) vient de montrer que le CT-P13, biosimilaire de l’infliximab est un traitement efficace et bien toléré. Ces données confortent l’intérêt d’utiliser les biosimilaires.
Pourquoi est-ce important ?
Le développement de biosimilaires est venu résoudre un problème de coût sur des traitements ayant révolutionné la prise en charge des MICI. Leur efficacité et tolérance versus le produit princeps a fait l’objet d’études en amont de leur commercialisation mais il est intéressant d’en évaluer la transposition en vie réelle.
Méthodologie
Cette étude observationnelle, prospective, multicentrique s’est intéressée à l’efficacité et à la tolérance du CT-P13, biosimilaire de l’infliximab, administré chez des sujets naïfs de traitement biologique ou ayant une réponse insuffisante à un autre anti-TNF ou ayant switché de l’infliximab original au biosimilaire. Les critères d’évaluation de l’activité de la maladie étaient l’indice de Harvey-Bradshaw>4 ou la présence d’une fistule périanale pour la la maladie de Crohn (MC) et un score partiel Mayo>2 pour la rectocolite hémorragique (RCH).
Principaux résultats
Au total, parmi les 220 patients souffrant de MICI traités par CT-P13 et inclus dans l’étude, 60% souffraient de MC et 40% de RCH. L’âge moyen était de 41,47 ans et 58% étaient des femmes. Sur l’ensemble de ces sujets, 9% avaient switché d’un traitement par infliximab original au biosimilaire, 65% étaient naïfs de tout traitement biologique avant d’avoir initié le traitement par CT-P13. À l’inclusion, 68,6% des individus présentaient une maladie active.
Une diminution significative des indices d’activité de la MC et de la RCH a été constatée à 3, 6 et 13 mois de traitement par CT-P13. Après 3 mois de traitement, 75,5% de la population avait atteint la rémission clinique ou une réponse clinique. Ils étaient 85,2% à avoir atteint ces mêmes critères à 12 mois de traitement. Si l’on considère la rémission clinique seule, sans recours aux corticoïdes, 64,2% des individus avaient atteint ce critère après 12 mois de traitement et 14,8% présentaient encore une maladie active. Parmi les patients qui avaient switché de l’infliximab princeps au biosimilaire (n=19), dix avaient terminé les 12 mois de suivi et parmi eux, 83,3% ont atteint la rémission.
À 3 mois, des anticorps anti-CT-P13 ont été retrouvés chez 10,5%, 4%, 6,7% et 26,1% des individus respectivement à 3, 6 mois, 9 mois et 12 mois.
Sur l’ensemble de la cohorte, des effets indésirables ont été rapportés pour 12,3% des individus. Les plus fréquents étaient des infections (23,5%) et des réactions au site d’injection (26,5%). Parmi les effets indésirables, 26,5% ont été qualifiés de graves.